无影灯兆丰光电5月26日讯
1 创新器械通过特别审查
5月24日,CMDE对外发布《创新医疗器械特别审查申请审查结果公示(2021年第7号)》。根据公示,Medtronic Inc.的“无导线起搏器”、上海联影医疗科技股份有限公司的“放射治疗计划系统软件”、上海微创电生理医疗科技股份有限公司的“心脏冷冻消融系统”,共3款产品通过创新医疗器械特别审查申请,拟同意进入特别审查程序。

《医疗器械监督管理条例》还有一周即将实施,对于医疗器械创新的鼓励支持将进一步加大,政策的支持,将加快企业创新的步伐。
2021年03月18日国家正式发布了《医疗器械监督管理条例》,自2021年06月01 日起实施,本次修订的主要变化之一是落实《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》的要求,加大对创新的鼓励支持。
2021年3月26日,国新办举行《医疗器械监督管理条例》国务院政策例行吹风会。司法部立法三局局长王振江在回答记者提问时表示,《条例》明确将医疗器械创新纳入发展重点,对创新医疗器械予以优先审评审批。完善医疗器械创新体系,在科技立项、融资、信贷、招标采购、医保等方面给予支持。同时加强知识产权保护,提高自主创新能力。
在具体制度措施上,《条例》优化了注册程序、提高了注册效率,实施告知性备案制度,科学设置临床评价要求,允许开展拓展性临床试验,鼓励医疗机构开展临床试验,加强医疗器械监管信息化建设。
2020年6月1日,《中华人民共和国基本医疗卫生与健康促进法》对创新医疗器械的审批做了专门的优化。
其中,第8条提到“国家加强医学基础科学研究,鼓励医学科学技术创新,支持临床医学发展,促进医学科技成果的转化和应用,推进医疗卫生与信息技术融合发展,推广医疗卫生适宜技术,提高医疗卫生服务质量。”
第65条中,又提到“国家加强对医疗器械的管理,完善医疗器械的标准和规范,提高医疗器械的安全有效水平”,并强调“国务院卫生健康主管部门和省、自治区、直辖市人民政府卫生健康主管部门应当根据技术的先进性、适宜性和可及性,编制大型医用设备配置规划,促进区域内医用设备合理配置、充分共享。”
在政策不断推进的同时,创新审评加速进展。
2 带动企业放量
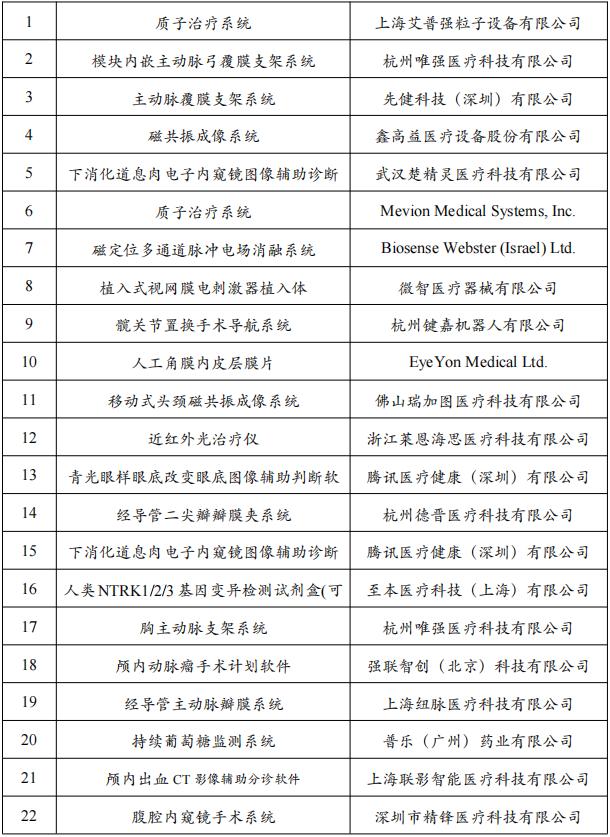
根据赛柏蓝器械的统计,去年同期,创新器械审评共通过18个产品,而今年截至目前,共有22个产品通过创新医疗器械特别审查申请,审评速度明显提快。
我们发现,创新医疗器械,心血管耗材占比超三分之一,虽然2020年心血管手术增速有所放缓,但是心血管创新器械相关企业的表现却不俗,根据各企业如乐普医疗、心脉医疗、佰仁医疗等创新器械企业的年报,可以看出,创新器械产品放量弥补了传统产品带来的损失。
乐普医疗:后续可降解支架、药物球囊、切割球囊等创新器械产品放量有望弥补传统金属支架的损失;
心脉医疗:作为主动脉及外周血管介入龙头,创新产品不断上市并放量;
佰仁医疗:动物源性植介入企业,当前产品以外科软组织修复、先心病植介入为主和心脏瓣膜置换与修复为主,正布局介入瓣膜的研发。
创新医疗器械,除了心血管器械外,癌症早筛、康复、骨科、影像等相关产品也在不断创新。
伟思医疗是国内康复器械医疗龙头,目前主要聚焦在电刺激、磁刺激、电生理以及配件耗材、以及康复机器人的生产研发与销售,聚焦在盆底、产康以及神经与精神领域。
影像方面,迈瑞是当之无愧的龙头企业,目前已建立起基于全球资源配置的研发创新平台,设有九大研发中心。“瑞影云++”通过连接迈瑞影像设备和用户的云端生态应用平台,创新性地提供了可供用户自主创建和运营的云社区以及多种云端应用,致力于为超声医疗工作者打造立体的交互沟通媒介。
2020年迈瑞保证高研发投入,全年研发投入 209,553.02 万元,同比增长 27.04%,产品不断丰富,持续推陈出新。
创新是器械企业升级的主旋律,在创新的路上,医疗器械企业迎来了2020 年的医疗器械牛市,展望未来,创新仍将推动医疗器械发展进入黄金时代。
2021年以来,已有22款产品通过创新医疗器械特别审查申请,同意进入特别审查程序。
免责声明:本站部份内容系转载,不代表本网站赞同其观点;如涉及内容、版权等问题,请在30日内联系,我们将在第一时间删除内容!